D’importantes découvertes ont placé l’intestin sur le devant de la scène scientifique. Le décryptage de ses bactéries pourrait révolutionner le traitement de nombreuses maladies.
L’intestin? «Un vaste peuple de bactéries, qui est l’addition des décisions que nous prenons, de la nourriture que nous ingérons, de l’environnement dans lequel nous vivons… C’est un peu notre collection personnelle de Pokémon!» C’est par ces mots que Giulia Enders décrit cet organe, avec assurance et beaucoup d’humour, dans un spectacle de «science-slam» qu’elle a présenté sur plusieurs scènes alémaniques. Cette jeune étudiante en médecine a ensuite publié le livre Darm mit Charme («Le charme discret de l’intestin»), devenu à la surprise générale l’un des plus gros succès de librairie de l’année en Allemagne (lire son interview p. 26).
Ce succès témoigne de l’intérêt croissant que suscite l’intestin auprès du grand public, mais aussi de la communauté médicale. Longtemps considéré comme un «simple organe de la digestion», ce tube de plus de 5 m de long, situé entre l’estomac et l’anus, joue en réalité un rôle central dans l’organisme.
Une avancée majeure a permis à l’intestin d’attirer tous les regards: la génétique moléculaire. «Grâce aux progrès de cette discipline, il est devenu possible de décrire le génome des 100’000 milliards de bactéries qui colonisent notre tube digestif, explique Jacques Schrenzel, responsable du laboratoire de bactériologie des Hôpitaux universitaires de Genève (HUG). Le défi actuel est de définir plus précisément «qui fait quoi» dans cette communauté bactérienne, que l’on appelle le ‘microbiote intestinal’.»
De nombreuses études ont confirmé une hypothèse que la communauté scientifique reconnaît aujourd’hui comme un fait: «Avoir un microbiote varié et équilibré prévient et protège de nombreuses pathologies, note Michel Maillard, gastro-entérologue au CHUV. Trouver le moyen de restaurer une diversité de bactéries, champignons et autres germes dans l’intestin s’apparente aujourd’hui à la quête du Graal pour des centaines de chercheurs à travers le monde.»
Car ces petits êtres ne vivent pas oisivement: ils contribuent activement à l’équilibre des fonctions physiologiques, et donc à l’état de santé générale, de leur hôte. «De nouvelles indications et de nouveaux traitements vont apparaître au fur et à mesure que la recherche sur le microbiote avancera, poursuit Jacques Schrenzel. Il va falloir reprendre tous les ouvrages actuels de médecine pour les mettre à jour tant ces découvertes auront une influence sur la prise en charge de nombreuses affections.» Et les maladies intestinales ne sont pas les seules concernées: depuis l’obésité jusqu’à la dépendance à l’alcool, en passant par la dépression et la boulimie, de nombreuses pathologies pourraient bénéficier à l’avenir de ces avancées.
Que font ces quelque 2 kg de microbes dans l’intestin? Leur implication dans le processus de digestion n’est pas remise en question. «Ils contribuent à la conversion des aliments en nutriments et en énergie, de même qu’à la synthèse de vitamines indispensables à l’organisme, rappelle Francisca Joly Gomez, gastro-entérologue au CHU Beaujon de Clichy (F).
Mais leur action va bien au-delà: ils dialogueraient constamment avec d’autres composantes de l’organisme, notamment avec le cerveau. «Nous savons depuis longtemps que le cerveau envoie des informations à l’intestin, mais nous pouvons désormais aussi affirmer qu’il s’agit d’une relation bidirectionnelle, c’est-à-dire que l’échange des informations s’effectue dans les deux sens», note la gastro-entérologue, qui a publié l’an dernier un ouvrage baptisé L’intestin, notre deuxième cerveau.
L’envoi et la réception d’informations se fait grâce au système neuronal de l’intestin. «Plus de 100 millions de neurones sont concentrés et connectés entre eux dans la paroi du tube digestif.» Que peut bien «dire» l’intestin au cerveau? «Il va par exemple lui envoyer des signaux «douloureux». Du gaz se produit dans l’intestin lors de la fermentation des aliments. Le gonflement de l’intestin peut entraîner des signaux douloureux visibles au niveau du cerveau», vulgarise la spécialiste.
La connexion entre le cerveau et l’intestin a permis de faire d’importantes découvertes sur la maladie de Parkinson: des travaux de chercheurs de l’Institut national de la santé et de la recherche médicale (Inserm) ont démontré que des anomalies présentes dans les neurones du cerveau des patients atteints de cette maladie dégénérative sont retrouvées «à l’identique» dans les neurones du système digestif. A l’avenir, il pourrait donc devenir possible d’identifier cette maladie par biopsie intestinale et d’établir un diagnostic précoce: «Les anomalies sur les neurones de l’intestin se manifesteraient avant leurs homologues cérébraux.»
Ces dix dernières années, plusieurs études sont venues confirmer le lien entre la maladie de Parkinson et les caractéristiques intestinales du malade. Parmi les plus récentes, celle de l’Université d’Helsinki affirme que les patients atteints de la maladie de Parkinson ont beaucoup moins de bactéries de la famille des Prevotellaceae dans leur intestin. «A présent, nous voulons comprendre si ces changements de l’écosystème bactérien apparaissent avant le début des symptômes cliniques de la maladie, explique le neurologue Filip Scheperjans. A l’avenir, nous nous concentrerons peut-être sur l’intestin pour soigner cette pathologie.»
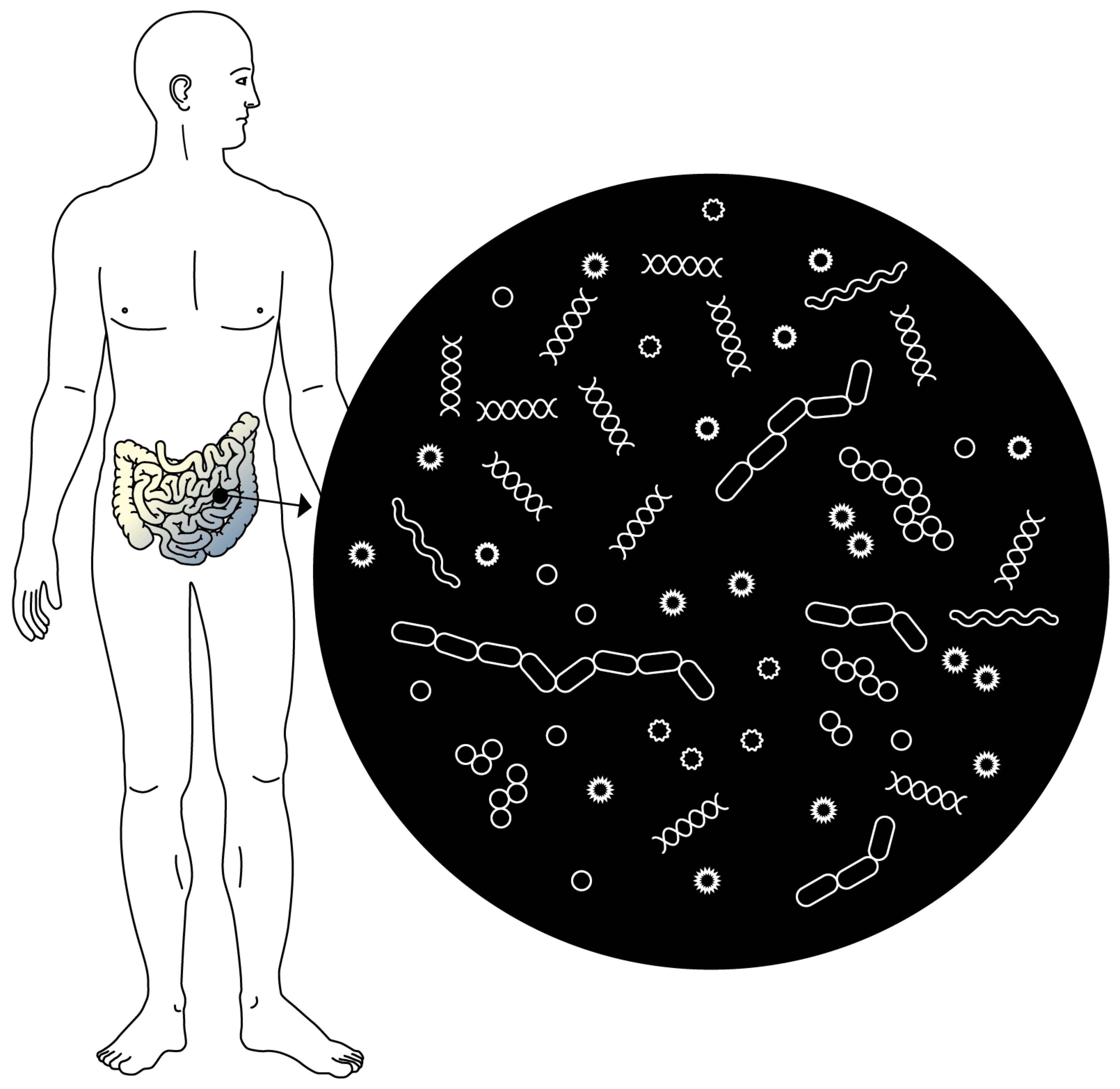
Un organe en soi. Le microbiote est l’écosystème composé des milliards de microorganismes qui colonisent les intestins. Il est aujourd’hui considéré comme un organe à part entière.
«Barrière protectrice»
Le cerveau n’est pas le seul interlocuteur de l’intestin: ce dernier communique aussi avec le système immunitaire. «Les bactéries du microbiote envoient des signaux aux récepteurs situés sur les cellules de la paroi intestinale, qui à leur tour donnent à nos cellules immunitaires un signal pour les aider à exclure les organismes pathogènes qui tenteraient de coloniser l’intestin», explique Francisca Joly Gomez.
Explorer ce rôle de «barrière protectrice» du microbiote ouvre de nouvelles pistes de traitements contre certaines pathologies, comme les allergies alimentaires. «Des tests sur des souris, auxquelles nous avons administré des allergènes de cacahuètes, nous ont montré que la présence de la bactérie Clostridium dans leur microbiote intestinal bloquait la réaction allergique, explique Cathryn Nagler, de l’Université de Chicago, qui a mené l’étude. Cela nous fait penser que cette bactérie en particulier agirait à travers certaines cellules immunitaires et empêcherait les protéines responsables des réactions allergiques de pénétrer dans la circulation sanguine.»
D’autres recherches menées par le Conseil supérieur de la recherche scientifique en Espagne, dont les résultats ont été publiés en octobre 2014 dans le journal de l’American Society for Microbiology, ont aussi dévoilé de nouvelles connexions entre le microbiote et certaines maladies auto-immunes: le microbiote intestinal de patients atteints de lupus, une maladie chronique qui s’attaque aux tissus sains de l’organisme, présente un déséquilibre du ratio entre les deux groupes de micro-organismes les plus nombreux dans l’intestin humain (les Bacteroides et les Firmicutes) en faveur des premiers.
A travers le monde, les efforts se multiplient pour tirer le meilleur profit de ces nouvelles connaissances (projets MetaHIT, MetaGenoPolis et MyNewGut en Europe, Human microbiome project aux Etats-Unis, etc.) et régulièrement, des résultats sont publiés dans les plus prestigieuses revues scientifiques.
«La pullulation de l’intestin grêle a finalement été démontrée et reconnue, se réjouit Alain Schoepfer, gastro-entérologue au CHUV. Il s’agit d’une concentration anormalement élevée de bactéries dans cet organe qui peut provoquer de fortes douleurs abdominales, des ballonnements ou des diarrhées. Nous savons à présent que l’administration d’un antibiotique, déjà utilisé pour le traitement des infections urinaires, peut améliorer efficacement l’état de santé du patient.»
Plusieurs travaux ont aussi éclairé le lien entre le microbiote et les maladies métaboliques comme l’obésité ou le diabète. Une équipe internationale dirigée par Jeffrey Gordon, de l’Ecole de médecine de l’Université de Washington, aux Etats-Unis, a par exemple montré que, introduit chez la souris, le microbiote d’un individu obèse fait grossir l’animal, contrairement au microbiote d’une personne mince. Le chercheur expliquait alors dans la revue Nature que «les bactéries intestinales ont un impact sur la régulation du stockage des graisses dans le tissu adipeux».
Le dialogue permanent entretenu entre l’intestin et le cerveau a permis à des scientifiques de se demander si le microbiote influence aussi le comportement de son hôte. Pour y répondre, des chercheurs de l’Université de Cork en Irlande ont procédé à des tests sur des souris dites «axéniques», c’est-à-dire sans bactéries, car élevées dans un milieu stérile depuis leur naissance. Celles-ci avaient un comportement social altéré: elles préféraient se trouver dans une cage vide plutôt que d’être entourées de leurs congénères. Leur attitude a changé lorsque des bactéries ont été inoculées dans leur système digestif, et partageaient volontiers leur lieu de vie.
«Tous ces travaux sur les souris sont précieux et nous fournissent des pistes intéressantes, note Michel Maillard. Il nous faut néanmoins tempérer notre enthousiasme pour l’instant, l’être humain ne réagira pas forcément de la même manière à ces tests.»
La dépendance à l’alcool et la boulimie font aussi partie des maladies pour lesquelles un lien avec le microbiote est soupçonné. Des recherches menées par une équipe de l’Université catholique de Louvain ont révélé que les patients alcooliques, présentant une altération du microbiote intestinal, sont plus dépressifs, plus anxieux et plus attirés par l’alcool que les alcooliques avec un microbiote «normal».
La protéine «ClpB» pourrait causer des troubles alimentaires. «Elle est fabriquée par certaines bactéries du tube digestif comme Escherichia coli, explique Sergueï Fetissov, de l’Institut national de la santé et de la recherche médicale de l’Université de Rouen. Elle est sécrétée quand les bactéries sont soumises à un stress. La ClpB a des propriétés anorexigènes, c’est-à-dire qu’elle diminue l’appétit et déclenche une réaction du système immunitaire produisant des anticorps dirigés contre elle. Ces anticorps vont aussi se lier à l’hormone de la satiété, du fait de son homologie de structure, et moduler son action vers l’anorexie ou la boulimie.»
Le réseau social fécal
L’intestin peut se targuer d’avoir son réseau social: My.microbes.eu. L’objectif annoncé par son créateur Peer Bork, biochimiste au Laboratoire européen de biologie moléculaire (EMBL) à Heidelberg (Allemagne): «Mettre en place une communauté dans laquelle les personnes au profil microbien similaire sont connectées.» Ceux qui veulent échanger sur leur pathologie digestive peuvent envoyer un échantillon de leur matière fécale à l’association. Pour 840 euros, les selles sont analysées et le génome bactérien est séquencé. Le participant connaîtra ainsi à quel entérotype (un groupe de composition bactérienne intestinale) il appartient et sera ainsi mis en réseau avec d’autres personnes partageant ses caractéristiques. Ils pourront ainsi échanger sur leurs éventuelles maladies, mode d’alimentation, environnement, etc. Ce projet s’inscrit dans la tendance de la médecine participative (lire «In Vivo» 2): l’équipe de My.microbes.eu bénéficie ainsi d’une immense base de données lui permettant de poursuivre ses recherches sur la flore intestinale.
«L’objectif sur le long terme est celui de prévenir ou de traiter certaines maladies de manière personnalisée chez les patients selon leur combinaison de souches bactériennes», note le microbiologiste genevois Jacques Schrenzel.
Plusieurs traitements nés de la recherche sur le microbiote sont déjà applicables. Le plus répandu est la transplantation fécale, c’est-à-dire la transfusion, par coloscopie, de selles fraîches provenant d’un donneur sain. «Nous réalisons cette intervention depuis 2014 chez les patients atteints de colite récidivante à Clostridium difficile, explique Michel Maillard. Il s’agit d’un germe dans certains cas réfractaire aux antibiotiques, qu’il faut pourtant évincer, car il cause des diarrhées à répétition avec parfois des conséquences graves.»
«Les taux de réponses à ce traitement avoisinent les 90%, ajoute Alain Schoepfer du CHUV. En moins de deux semaines, les patients se portent bien.» Le donneur de selles est généralement un proche du patient. «Avant la transfusion, nous effectuons un bilan microbiologique chez le donneur, qui doit bien sûr être en bonne santé et ne pas être porteur de Clostridium difficile.»
A Genève, les HUG aussi réaliseront ce type d’intervention dès le printemps 2015. «Dans un premier temps, nous utiliserons cette méthode pour soigner les patients présentant une infection récidivante à la bactérie Clostridium difficile, mais nous espérons pouvoir aussi y recourir chez des malades atteints de maladies inflammatoires de l’intestin comme la maladie de Crohn ou les colites ulcéreuses», se réjouit Jacques Schrenzel.
Si aucune contre-indication n’existe à la transplantation fécale, les effets secondaires sur le long terme ne sont pas connus. «Nous injectons chez un patient une «black box» de plusieurs milliards de microbes, rappelle Alain Schoepfer. Nous savons que cela va soigner une pathologie ciblée, mais est-ce que ce «nouveau» microbiote va provoquer une autre maladie chez lui? Nous expliquons ces risques aux patients, qui doivent nous donner leur consentement.»
Ce traitement reste surtout beaucoup moins invasif qu’une greffe d’un organe dans son ensemble. «Les transplantations d’intestin grêle sont très rares, explique Nicolas Desmartines, chef du Service de chirurgie viscérale du CHUV. Il s’agit d’un organe très sensible notamment pour des questions de rejets et d’infections. Quand on opère une intestin grêle, il peut faire des «brides», des occlusions qui bloquent le transit, entrainant de fortes douleurs abdominales. L’organe peut s’arrêter de fonctionner pendant 2 ou 3 jours. Quant au côlon, sa transplantation n’est pas pratiquée, car l’organe contient un nombre inimaginable de bactéries, donc ne se prête pas à une transplantation. Sa fonction peut être reprise en partie par l’intestin grêle.»
L’alimentation reste aussi une option pour ingérer de «bonnes» bactéries. «Des probiotiques, qui sont des micro-organismes vivants, sont déjà ajoutés à certains produits, comme les yaourts, note Michel Maillard. Aujourd’hui, des grands groupes de l’industrie agro-alimentaire tentent d’introduire davantage de germes dans des biens comestibles. Nous les trouverons peut-être à l’avenir dans nos supermarchés.»
«Si un jour nous parvenons à déterminer quel est le microbiote «idéal», nous pourrions développer sous forme d’une pilule un traitement pour tenter de rétablir un diversité du microbiote, mais surtout un équilibre microbien, imagine Francisca Joly Gomez. Le chemin sera long avant d’en arriver là. Nous avons déjà effectué un grand pas en acceptant un changement de paradigme: il n’est pas toujours nécessaire de détruire les «mauvaises» bactéries à coups d’antibiotiques, mais il nous faut apprendre à vivre en harmonie avec elles.»
L’intestin ou les intestins? La forme plurielle est en quelque sorte plus adaptée, car derrière cette appellation se cachent deux organes: l’intestin grêle, ce tube de 6 m de long environ, qui se charge de l’absorption des nutriments, et le gros intestin (ou côlon). Ce dernier, qui mesure entre 80 et 150 cm, va principalement stocker les déchets, absorber certaines vitamines et l’eau résiduelle pour agglomérer les selles. Des bactéries colonisent l’ensemble du tube digestif, mais
la grande majorité du microbiote
se trouve dans le côlon.
La taille de la surface intestinale, soit l’équivalent de deux courts de tennis.
Le pourcentage du microbiote que contient le côlon, le reste est dispersé dans l’ensemble du système digestif.
Le nombre d’espèces bactériennes identifiées dans le microbiote intestinal humain.
Il n’y en a que 150 à 170 prédominantes par individu.
Le nombre de gènes dans le microbiote intestinal, soit 150 fois plus que de gènes dans le génome humain.
Le nombre de bactéries qui colonisent l’intestin, c’est-à-dire dix fois plus que le nombre de cellules humaines.
Le poids de l’ensemble des bactéries qui vivent dans l’intestin.
vrai Un tiers de notre microbiote intestinal est commun à la plupart des individus, tandis que les deux autres tiers sont spécifiques à chacun d’entre nous.
faux Le microbiote intestinal commence à se développer à la naissance. Stérile à l’intérieur de l’utérus, le tube digestif d’un nouveau-né est rapidement colonisé par les micro-organismes de sa mère (vaginaux, fécaux, cutanés, etc.) et ceux de l’environnement de son lieu de naissance. La composition du microbiote intestinal variera en fonction de son alimentation. Les scientifiques estiment qu’aux alentours de 3 ans, le microbiote devient stable et continue à évoluer à un rythme régulier pendant toute la vie de la personne.
vrai/faux De nombreuses études ont démontré des effets bénéfiques des probiotiques sur le microbiote intestinal, comme notamment de maintenir son équilibre et sa diversité. En revanche, des recherches menées par le microbiologiste français Didier Raoult ont mis en avant des effets indésirables de ces bactéries: ils pourraient favoriser l’obésité.
Plusieurs études, comme celle de l’Institut national de la recherche agronomique, ont démontré que la pauvreté bactérienne serait associée à la surcharge pondérale. Ce manque de diversité augmente le risque de développer des complications liées à l’obésité, comme du diabète ou des maladies cardiovasculaires
Les recherches menées par l’Université catholique de Louvain ont montré que certains alcooliques présentent des altérations de la composition du microbiote intestinal. Une découverte qui ouvre de nouvelles pistes thérapeutiques ciblant l’intestin et non plus seulement le cerveau pour lutter contre la dépendance à l’alcool.

Des chercheurs de
l’Institut de technologie de Californie ont amélioré plusieurs symptômes de l’autisme chez la souris en lui administrant une bactérie humaine, Bacteroides fragilis, connue pour favoriser la cohésion de la paroi du côlon.
Chez les patients atteints de maladies inflammatoires chroniques de l’intestin, des bactéries potentiellement pathogènes sont trouvées en excès tandis que la concentration de bactéries bénéfiques du groupe des Firmicutes est diminuée à la fois en espèces et en proportion.